Подтверждение амилоидной природы агрегатов, образуемых белками семейства тайтина (тайтина, Х-белка, С-белка и Н-белка) при их взаимодействии со специфическими красителями на амилоиды
Конго красным и тиофлавином Т
Основным методом выявления амилоидной природы фибрилл, образуемых разными белками, является их способность взаимодействовать со специфическими красителями Конго красным и тиофлавином Т (Klunk et al., 1989; LeVine, 1993, 1995; Krebs et al., 2005). Именно эти красители используют в клинической практике для определения амилоидных отложений in vivo и для исследования амилоидогенеза in vitro разными белками.
При окрашивании Конго красным фибриллярных структур, формируемых исследуемыми белками, мы наблюдали двойное лучепреломление в поляризационном микроскопе, а при окрашивании их тиофлавином Т – желто-зеленую флуоресценцию в люминесцентном микроскопе. На рис. 16 представлены данные связывания Х-фибрилл, сформированных в растворе, содержащем 30 мМ KCl, 10 мМ имидазола, рН 7.0, с красителями Конго красным и тиофлавином Т.
При спектральных исследованиях интенсивность флуоресценции тиофлавина Т в присутствии фибрилл Х-, Н- и С-белков и тайтина возрастала в ~10, ~9, ~7 и ~5 раз соответственно по сравнению с интенсивностью флуоресценции красителя в присутствии этих белков в молекулярной форме (рис. 17). Незначительное увеличение интенсивности флуоресценции тиофлавина Т наблюдается и в присутствии молекулярных форм тайтина, Х-, С- и Н-белков, что согласуется с литературными данными для белков, содержащих β-складчатую структуру (LeVine, 1993; 1995).
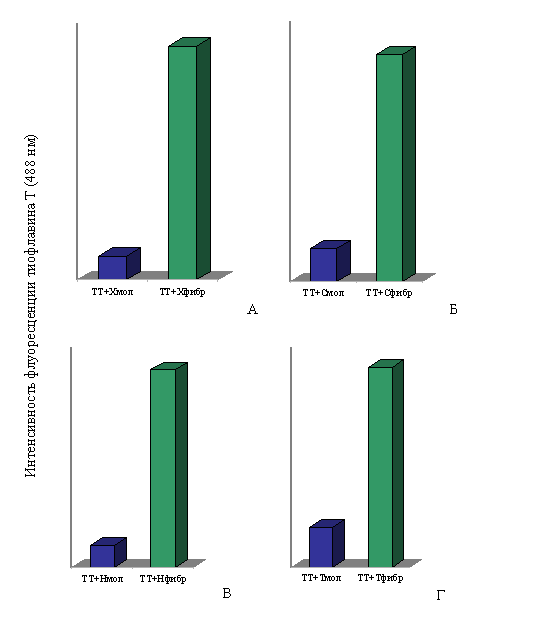
Рис. 17. Интенсивность флуоресценции тиофлавина Т (TT): А – в присутствии молекулярного X-белка (в растворе, содержащем 0.3 M KCl, 10 мМ К-фосфат, рН 7.0) и в присутствии фибрилл X-белка (0.15 М глицин-KOH, рН 7.5); Б – в присутствии молекулярного С-белка (0.3 M KCl, 10 мМ К-фосфат, рН 7.0) и в присутствии фибрилл С-белка (0.15 М глицин-KOH, рН 7.5); В – в присутствии молекулярного Н-белка (0.3 M KCl, 10 мМ К-фосфат, рН 7.0) и в присутствии фибрилл Н-белка (0.15 М глицин-KOH, рН 7.5); Г – в присутствии молекулярного тайтина (0.6 М KCl, 30 мМ KH2PO4, рН 7,0) и в присутствии фибрилл тайтина (0.15 М глицин-KOH, рН 7.5). Молярное соотношение красителя и белка 1:2.
При измерении спектральных характеристик раствора Конго красного в присутствии фибрилл тайтина, Х-, С- и Н-белков наблюдался сдвиг спектра поглощения красителя в длинноволновую область от ~490 нм к ~500 нм (рис. 18), что также является характерной чертой при связывании амилоидных фибрилл с Конго красным (Klunk et al., 1989).
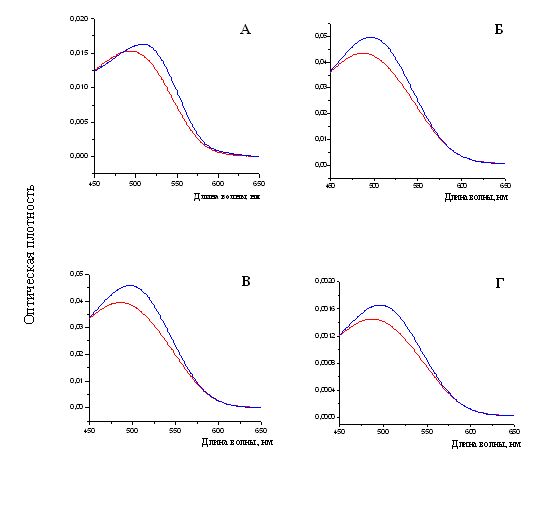
Рис. 18. Спектры поглощения свободного красителя показаны линиями красного цвета. Спектры поглощения красителя Конго красного (линия синего цвета): А – в присутствии фибрилл X-белка (в растворе, содержащем 0.15 М глицин-KOH, рН 7.5); Б – в присутствии фибрилл С-белка (0.15 М глицин-KOH, рН 7.5); В – в присутствии фибрилл Н-белка (0.15 М глицин-KOH, рН 7.5); Г – в присутствии фибрилл тайтина (0.15 М глицин-KOH, рН 7.5). Молярное соотношение красителя и белка 1:2.
Проведенные исследования указывают на специфичность связывания красителей с фибриллярными агрегатами, образуемыми белками семейства тайтина, подтверждая их амилоидную природу.
Популярные статьи:
Периодизация индивидуального развития (онтогенеза)
Онтогенез - комплекс последовательных преобразований организма, начиная со стадии оплодотворения яйцеклетки и до окончания жизненного цикла.
Пифагор (VI в. до н.э.) выделял 4 периода человеческой жизни: весну (до 20 лет), лето (20-40 лет ...
Афоризмы и советы ученого
Уотсон – нестандартный человек по своей натуре. Поэтому многие биографы и почитатели старались запечатлеть его высказывания и советы в отношении занятий наукой и упоминают об этом в своих исследованиях.
Имеется информация по данному вопр ...
Защита акации белой от вредителей и болезней
К достоинствам акации белой следует отнести ее высокую устойчивость против вредителей и болезней. В отличие от дуба, который в условиях степи подвергается нападению со стороны многих насекомых, акация белая повреждается лишь немногими пре ...

