Антиоксидантные свойства дигидрокверцетинаСтраница 1
Первым этапом наших исследований было изучение антиоксидантных свойств дигидрокверцетина. Антиоксидантная активность (АОА) определяется различными методами, в том числе наиболее часто для этой цели используют модельную систему: люминол-H2O2-катализатор, где в качестве катализатора могут выступать пероксидаза, гемоглобин или соли металлов переменной валентности. Под антиоксидантными свойствами соединения подразумевают его антиокислительную (АОА) и антирадикальную активности (АРА). Антиокислительная активность определяется различными методами, в том числе наиболее часто для этой цели используют модельную систему: люминол-H2O2-катализатор, где в качестве катализатора могут выступать пероксидаза, гемоглобин или соли металлов переменной валентности. В данной работе определяли АОА и АРА ингибиторов свободнорадикальных реакций в модельной биохимической системе, содержащей люминол, пероксидазу хрена и пероксид водорода.
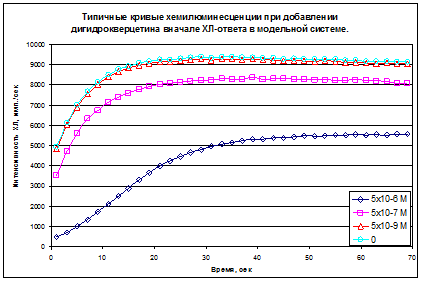
Рис.6 Типичные кривые интенсивности хемилюминесцентного ответа в модельной системе в зависимости от концентрации дигидрокверцетина (введение антиоксиданта до начала реакции).
Если рассмотреть модельную систему с точки зрения образования РФК, понятно, что в начальный период основной формой окислителя является перекись водорода, вследствие чего добавка антиоксиданта в начале ХЛ-ответа позволяет судить нам о его антиокислительных свойствах.
С другой стороны достижение равновесия, визуально наблюдаемого в максимуме хемилюминесценции, сопровождается взаимодействием антиоксиданта как с молекулярной формой (H2O2), так и наиболее предпочтительнее с его радикальными формами, позволяя судить об антирадикальных свойствах.
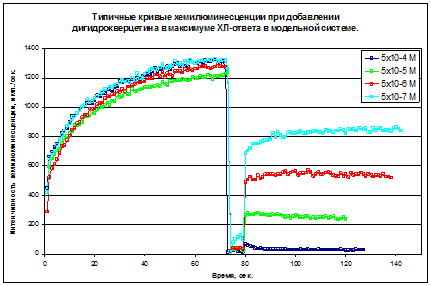
Рис.7 Типичные кривые изменения уровня РФК в максимуме хемилюминесценции при добавлении дигидрокверцетина.
Антиоксидантные свойства флавоноидов (в том числе и для ДГК) напрямую зависят от их липофильных свойств, т.е. с уменьшением молекуляной массы увеличивается их АРА. Тем не менее, не только это является основополагающим для данной группы антиоксидантов. Такие производные, как пентаацетат ДГК и пентабензоат ДГК обладают слабой активностью, вследствие отсутствия свободных группировок, и единственно возможным путем реагирования со свободными радикалами может быть присоединение радикала по карбоксильной группе с образованием метастабильных радикалов орто-кислот, с дальнейшим отщеплением эфирной группировки (Шаталин Ю.В., и др. 2008). Альтернативный механизм реакции с подобными антиоксидантами является гидролитическое расщепление антиоксиданта до исходных компонентов и дальнейшая реакция их с радикальными формами. Второй путь является известным явлением, характерным для расщепления производных флавноноидов и эфиров полифенольных соединений в организме животных. Подобное расщепление выполняется рядом арилэстераз, присутствующих и в плазме крови. Но в модельных системах данный процесс маловероятен.
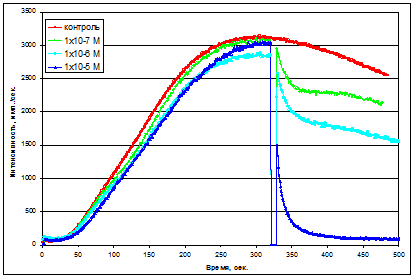
В качестве другой модельной системы была выбрана система, где в качестве источника генерации АФК были использованы полиморфноядерные лейкоциты (ПМЯЛ) здорового животного и опухоленосителя, которые в ответ на стимул (ФМА) способны продуцировать супероксид-анион с последующим молекулярным превращением его в другие активные формы кислорода. Такой подход позволяет оценить действие антиоксидантов на респираторный взрыв фагоцитов. В системе данного типа происходит взаимодействие антиоксидантов с радикальными формами кислорода.
В данной системе наблюдалось снижение чувствительности системы к возрастающему количеству антиоксиданта, что связано с насыщенностью им водной фазы и накоплением в липидном слое клеточной мембраны и что проявляется в расхождении между значениями между антиоксилительной активностью и антирадикальной активностью флавоноида на 2 порядка. Благодаря постоянной диффузии между двумя фазами и по мере окисления антиоксиданта в растворе, происходит обмен окисленных форм антиоксиданта на восстановленные из липидной фазы.
Скорость взаимодействия с АФК лимитируется только диффузионной составляющей. Для гидрофильных антиоксидантов (гипоксен и аскорбиновая кислота) такого эффекта не наблюдается, и сужение разностной гистограммы наблюдается только при 95% ингибировании хемилюминесценции (Шаталин Ю.В., и др. 2008).
В результате исследований было обнаружено, что концентрация антиоксиданта, необходимая для снижения ХЛ-ответа в клеточной системе, на порядок больше, чем в модельной биохимической системе. При действии гидрофобного антиоксиданта на клетки, происходит частичное распределение его в липидной компоненте мембраны, тем самым увеличивается концентрация антиоксиданта, требуемая для снижения АФК в водной фазе.
Популярные статьи:
Морфология нервной системы и анализаторов
Нервная система регулирует все функции организма. Она обусловливает единство - целостность организма путем согласования (координации) работы всех органов друг с другом.
Нервная система осуществляет свою деятельность по принципу обратной ...
Роль комбинативной изменчивости
Большинство организмов размножаются при посредстве гамет, разноименных по полу и индивидуальности. Так, например, хотя среди растений есть много самоопылителей, но, как оказывается, только немногие являются облигатно (обязательно) самоопы ...
Обсуждение результатов
1. Получение микрокапсул с ХТР на основе
CaCO
3
-частиц
Полиэлектролитные микрокапсулы были получены ступенчатой адсорбцией [5] противоположно заряженных Alg и PLL на твердых CaCO3-частицах. Впервые микрочастицы из карбоната кальция был ...

