Современные представления о строении и формировании амилоидных фибриллСтраница 3
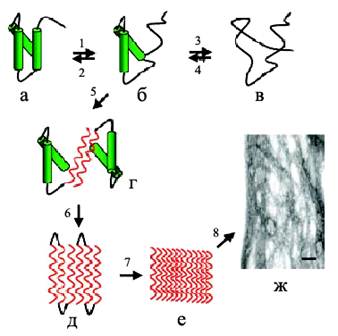
Рис. 4. Образование амилоидных фибрилл: (а) – нативная структура белка, (б) – промежуточное состояние, в котором части полипептидной цепи находятся в ненативной конформации, (в) – полностью развернутое состояние, (г) – образование межмолекулярного β-слоя, опосредованное развернутыми областями приводит к олигомеризации белка, (д) –дальнейшее образование β-складчатой структуры, (е) – образование протофибрилл, (ж) –формирование зрелых фибрилл (Jobansson, 2003).
Чемберлейн в 2000 г. показал, что фибриллы, образованные различными белками, обладают сходными структурными свойствами: все они образованы из протофибриллярных нитей, имеющих 2–5 нм в диаметре и содержащих от двух до пяти β-слоев. При этом размеры протофибрилл никак не связаны с количеством аминокислотных остатков белка-предшественника фибриллообразования. Так протофибриллы SH3 домена, включающего 90 аминокислотных остатков, состоят из двух β-слоев, а лизоцим, состоящий из 130 аминокислотных остатков, образует протофибриллярные нити, содержащие четыре β-слоя (Chamberlain et al., 2000).
Популярные статьи:
Гольджи аппарат: функции
Функцией аппарата Гольджи является транспорт и химическая модификация поступающих в него веществ. Исходным субстратом для ферментов являются белки, поступающие в аппарат Гольджи из эндоплазматического ретикулума. После модификации и конце ...
Кроветворение и регуляция системы крови
Гемопоэз - совокупность процессов образования и разрушения форменных элементов крови.
Эритропоэз - процесс образования в костном мозге эритроцитов Он протекает в среднем за 5 дней. Из костного мозга в кровь поступают ретикулоциты, созрев ...
Принципы вычисления
адаптационного потенциала системы кровообращения
Распознавание функциональных состояний на основе анализа данных о вегетативном и миокардиально-гемодинамическом гомеостазе требует определённого опыта и знаний в области физиологии и клинической медицины. Для того, чтобы сделать метод оце ...

